Flavinbundne dehydrogenaser og oxidaser |
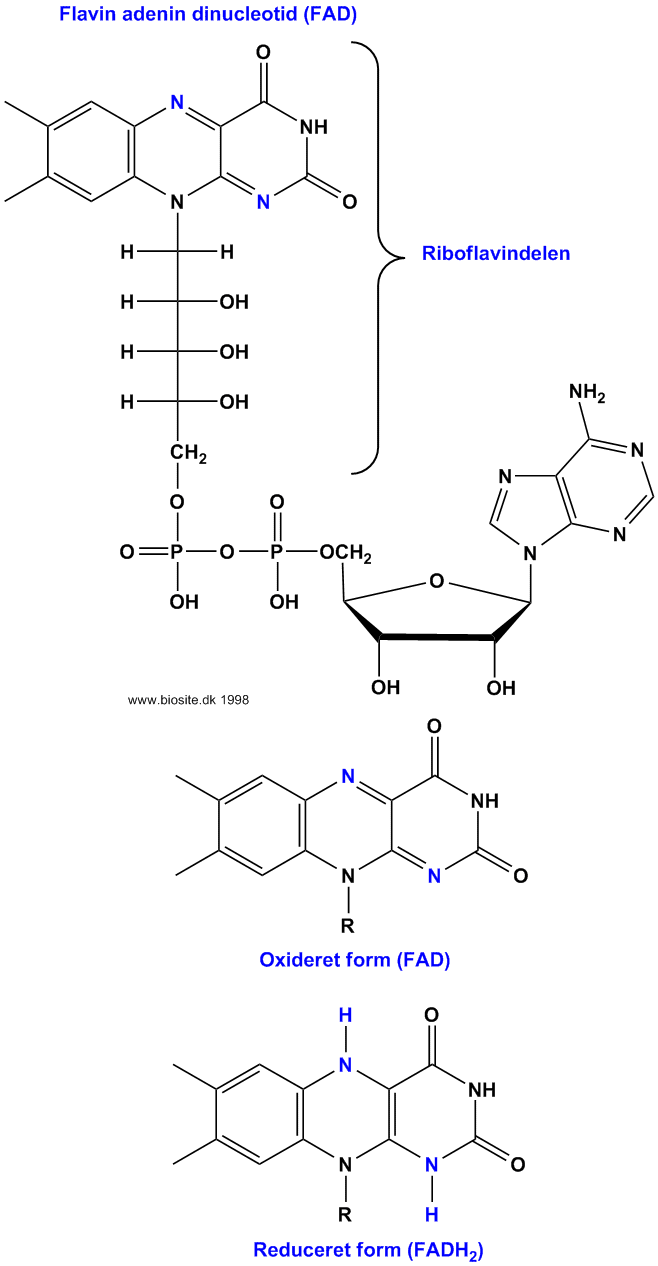
Disse enzymer indeholder som prosthetisk gruppe enten flavin mononucleotid (FMN) eller flavin adenin dinucleotid (FAD) - se figurerne nedenfor. Den aktive del af FMN og FAD der deltager i oxido-reduktionen er isoalloxanringen af riboflavindelen (se vitamin B2), som kan reduceres reversibelt, denne reaktion er en direkte overførsel af et par hydrogenatomer fra substratet og giver de reducerede formen betegnet FMNH2 og FADH2:
![]()
![]()
Hvor S er substratet og E er proteindelen af enzymmolekylet
De vigtigste flavinbundne dehydrogenaser i hovedstrømmen af respirationen og elektrontransporten er alle lokaliseret i mitochondrierne. Flavinbundne dehydrogenaser adskiller sig fra pyridin bundne dehydrogenaser ved at flavin nucleotidet er bundet meget fast til enzymproteinet og fungerer mere som en prosthetisk gruppe end som coenzym. Flavin nucleotidet forlader ikke enzymmolekylet under eller efter den katalytiske cyclus. I de fleste flavindehydrogenaser er flavinnucleotidet ikke kovalent bundet men dissociationskonstanten ligger i området 10-8 - 10-11 M, sådanne flavoenzymer kan ofte dissocieres ved at udsætte dem for høj ionstyrke eller lav pH. Hos andre flavoenzymer er flavinnucleotidet bundet kovalent med en binding mellem isoalloxanringen hos FAD og en aminosyrerest på enzymproteinet. Flavinbundne dehydrogenaser kan opstilles i to klasser: Dehydrogenaser og oxidaser, afhængig af deres evne til at reagere med elektronacceptorer, i flavin dehydrogenaser som NADH dehydrogenase i elektrontransportkæden er der lille el. ingen tendens hos den reducerede form af flavinnucleotidet til at blive reoxideret af molekylært oxygen, modsat er flavin oxidaser som reoxideres af oxygen og giver hydrogenperoxid. Hos medlemmerne af denne gruppe er flavinnucleotidet bundet til proteinet på en sådan måde at den reducerede form af nucleotidet kan reagere med oxygen. De reducerede flavindehydrogenaser reoxideres også af visse kunstige elektronacceptorer som ferricyanid eller de reductible farvestoffer som methylenblåt, phenazinmethosulfat el. 2,6-dichlorophenolindophenol, disse farvestoffer ændrer deres absorptionsspektra når de reduceres af flavindehydrogenaser. I deres fuldt oxiderede former er de forskellige flavindehydrogenaser gule, røde, brune el. grønne. De har sædvanligvis brede absorptionsmaxima omkring 370 nm og 450 nm, når de er fuldt reducerede kan de blegne med tab af 450 nm absorptionen. Visse flavoproteiner indeh. også metalioner, især Fe og Mo, disse metalioner er essentielle for den katalytiske aktivitet. De jern-indeholdende flavoenzymer indeh. især reaktive svovlatomer. Jernatomerne i jern-svovl flavoproteinerne undergår Fe(II) - Fe(III) ændringer og deltager i elektrontransporten til og fra flavingruppen.
Se også: Oxygenaser, glycerol phosphat shuttlen, pyrroloquinolin quinon og NAD.

BioSite 10/11,98; 2/2,14