Syrer og baser |
Andre navne: (Eng.: Acids and bases)
Der er to definitioner på syrer og baser: Brønsted-Lowry og Lewis.
Brønsted-Lowry
En Brønsted-Lowry syre-base reaktion er en reaktion hvor der udveksles en hydron (H+) mellem to molekyler eller ioner:

Lewis definitionen omfatter deling af elektroner:
En stærk Brønsted syre mister let en hydron (en hydrondonor), medens en stærk Brønsted base let optager en hydron (en hydronacceptor), fx:
(3)![]()
Her optræder saltsyren som hydrondonor, medens vand optræder som hydronacceptor og danner chloridionen (Cl-) og oxoniumionen (H3O+). Alle syre-base reaktioner omfatter derfor to korresponderende syre-base-par i ligevægt som vist i (1) og (3). Den korresponderende base af en stærk syre er en svag base. Den korresponderende syre af en stærk base er en svag syre. Man kan opskrive et tilsvarende reaktionsskema for vand:
(4)![]()
Vand er derfor en amfoter (amfolyt) forbindelse idet det både kan optræde som syre og som base, vand kan ligeledes benævnes en amfoprotisk forbindelse idet det både kan miste og optage en hydron. Syrer der kan miste en hydron benævnes protiske og efter antallet af hydroner de kan miste kan de benævnes: Monoprotiske (fx HCl), diprotiske (fx H2SO4) eller triprotiske (H3PO4).
Lewis
Lewis syre-base definitionen er bredere end Brønsted-Lowry idet en Lewis syre er et atom, molekyle eller ion der kan virke som en elektron-par acceptor. Medens en Lewis base er et atom, molekyle eller ion der kan virke som en elektron-par donor.

Lewis syre-base definitionen er dermed så bred at alle reaktioner (bortset fra oxidations-reduktions reaktioner) kan betragtes som syre-base reaktioner. Nedenfor ses nogle flere eksempler.
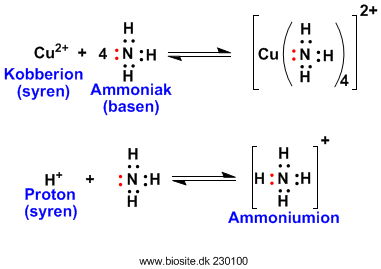
Surt og basisk
Som vist i (4) kan vand optræde både som syre og som base, man taler om vands ioniseringsligevægt, hvor reaktionen er stærkt forskudt mod venstre. Ved 25oC er koncentrationen (i rent vand) af hhv. H+ og OH- 1x10-7 mol/liter da rent vand er neutralt (pH 7,00) vil det betyde at en opløsning der indeholder mere end 1x10-7 mol/liter H+ er sur, modsat hvis den indeholder mere end 1x10-7 mol/liter OH- da er den basisk (eller alkalisk). Koncentrationen af H+ og OH- (OH- = hydroxyl-ion) kan ligge i området 100 til 10-14 mol/liter. Da det før lommeregnerens tid var bøvlet at arbejde med så små tal fandt man på en logaritmisk notering i stedet og definerede pH og pOH som følger:

Eksempel: pH af en 0,01M opl. af H2SO4 (fuldt ioniseret) er -log [H+] = -log 2x10-2 = 1,699, to-tallet stammer fra de to hydroner der er i H2SO4.
Vands ionprodukt (Kv) er defineret som multiplaet af hydroner og hydroxylioner i rent vand (dvs. neutralt, pH = 7,00) ionproduktet: [H+] [OH-] giver da 1x10-7 x 1x10-7 = 1 x 10-14 eller i den logaritmiske notation: pKv = pH + pOH.
Se også: Carboxylsyrers syrestyrke, korresponderende syrer og baser og tabellerne m. syrer og baser samt artiklen om stærke og svage syrer.
BioSite 22/1,00; 11/9,22